Cục Quản lý Dược (Bộ Y tế) vừa quyết định thu hồi số tiếp nhận phiếu công bố, đình chỉ lưu hành và tiêu hủy 77 sản phẩm mỹ phẩm của Công ty TNHH Ucanrely.
Cục Quản lý Dược (Bộ Y tế) đã ban hành Quyết định số 41/QĐ-QLD ngày 19/01/2026 về việc thu hồi số tiếp nhận Phiếu công bố sản phẩm mỹ phẩm, đồng thời đình chỉ lưu hành, thu hồi và tiêu hủy đối với hàng loạt sản phẩm mỹ phẩm.
Quyết định này được đưa ra dựa trên kết quả kiểm tra hậu mại đối với Công ty TNHH Ucanrely, có địa chỉ tại số 194 đường Lạc Trung, Phường Vĩnh Tuy, Quận Hai Bà Trưng, Thành phố Hà Nội.
 |
| Cục Quản lý Dược (Bộ Y tế) vừa quyết định thu hồi số tiếp nhận phiếu công bố, đình chỉ lưu hành và tiêu hủy 77 sản phẩm mỹ phẩm của Công ty TNHH Ucanrely. (Ảnh chụp màn hình) |
Theo nội dung quyết định, lý do chính dẫn đến việc thu hồi là do doanh nghiệp này không có Hồ sơ thông tin sản phẩm (PIF) để xuất trình cho cơ quan có thẩm quyền theo quy định pháp luật hiện hành. Danh mục các sản phẩm bị ảnh hưởng bao gồm 77 loại mỹ phẩm thuộc nhiều nhãn hàng phổ biến như Hatomugi, Softymo, Rosette, Ichikami, Bigen và Skin Aqua.
Trong số các sản phẩm bị đình chỉ lưu hành, đáng chú ý có các dòng sản phẩm chăm sóc da và tóc như dầu gội Ichikami Smooth Care, gel chống nắng Hatomugi The Tone Up UV Milky Gel, dầu tẩy trang Softymo Speedy Cleansing Oil và các loại kem đánh răng trẻ em Lion. Toàn bộ các số tiếp nhận Phiếu công bố này đã được cấp trong khoảng thời gian từ tháng 5 đến tháng 6 năm 2024.
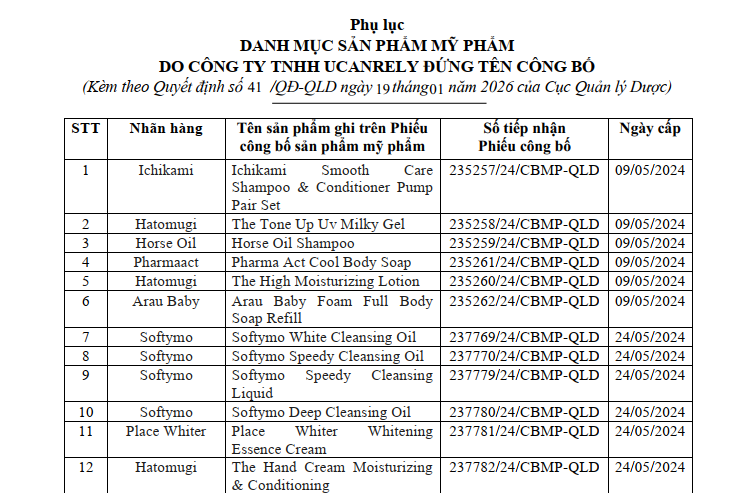 |
| Một số sản phẩm bị thu hồi theo Quyết định số 41/QĐ-QLD ngày 19/01/2026 của Cục Quản lý Dược. (Ảnh chụp màn hình) |
Cục Quản lý Dược giao Sở Y tế các tỉnh, thành phố trực thuộc Trung ương thông báo rộng rãi cho các cơ sở kinh doanh và sử dụng mỹ phẩm trên địa bàn ngừng ngay việc kinh doanh, sử dụng các sản phẩm vi phạm. Đồng thời, các cơ quan chức năng địa phương có trách nhiệm kiểm tra, giám sát quá trình thu hồi và tiêu hủy sản phẩm của Công ty TNHH Ucanrely.
Các đơn vị vi phạm, nếu tiếp tục kinh doanh hoặc không thực hiện nghiêm túc việc thu hồi, sẽ bị xử lý nghiêm theo quy định. Sở Y tế các địa phương phải báo cáo kết quả thực hiện về Cục Quản lý Dược trước ngày 25/01/2026 để tổng hợp và theo dõi. Quyết định này có hiệu lực thi hành kể từ ngày ký ban hành là ngày 19/01/2026.




